依沃西单抗是康方生物子公司康方赛诺有限公司研发的PD-1/VEGF双特异性抗体药物。作为全球首个获批的“肿瘤免疫+抗血管生成”机制双抗新药,通过同时结合VEGF-A和PD-1阻断其与配体相互作用发挥抗肿瘤活性。
截至目前,依沃西单抗注射液分别于2024年5月、2025年5月,获批治疗进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌、PD-L1表达阳性的晚期NSCLC适应症。
同时,康方生物也在通过三期临床试验验证依沃西单抗联合化疗在鳞状非小细胞肺癌、一线转移性结直肠癌、晚期不可切或转移三阴性乳腺癌、复发性头颈癌PD-L1阳性患者、一线晚期胆道癌、一线转移性胰腺癌等有效性。
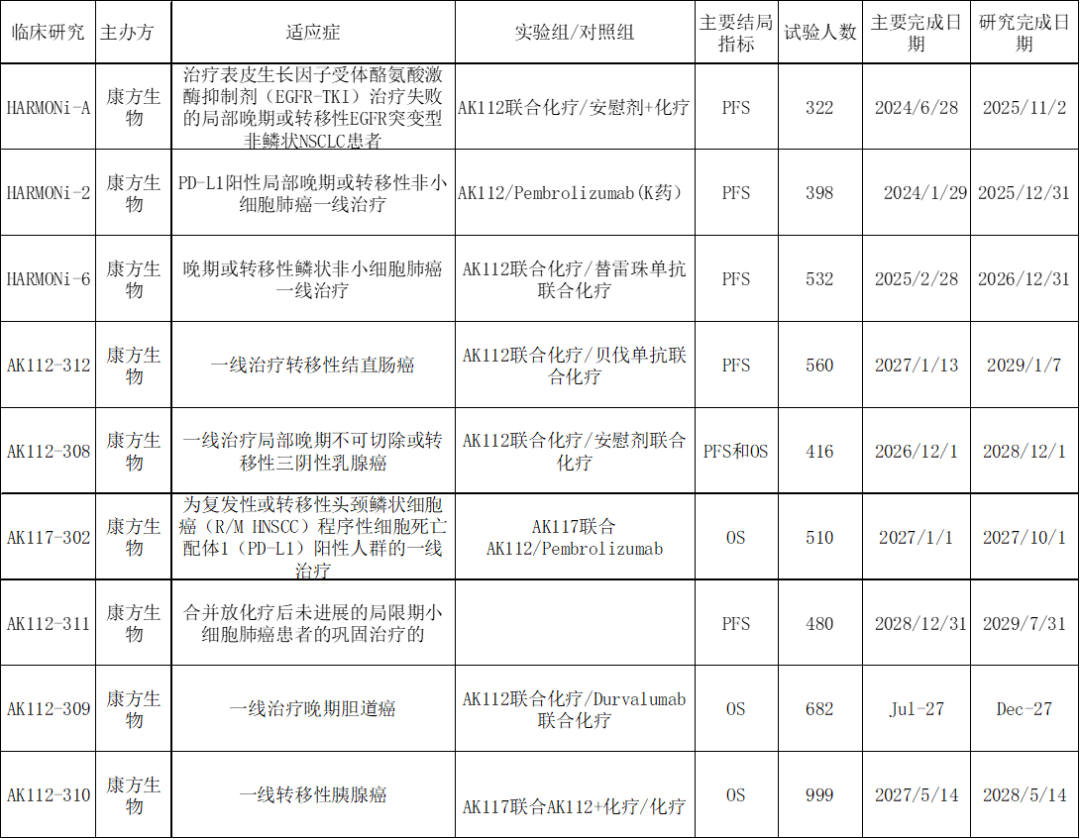
资料来源:clinicaltrials.gov
图表1:依沃西单抗(AK-112)国内三期临床情况 另外,康方生物将AK112的大中华区之外权益授权给了美国药企SMMT,SMMT在美国FDA注册了四项临床试验,其中三项集中肺癌领域、一项在结直肠癌领域。

数据来源:SMMT公告
图表2:SMMT处于临床三期的试验 也就是说,AK112的销售峰值取决于康方生物的国内市场开发和SMMT的全球市场开发。
01 PD-1/VEGF双抗是PD-1单抗的升级还是替代?PD-1(programmedcelldeathprotein1)是程序性死亡受体1,是重要的免疫抑制分子,肿瘤细胞通过上调PD-L1表达,与T细胞上的PD-1结合阻断了T细胞活化,T细胞功能受到的抑制,肿瘤细胞实现了免疫逃逸。而PD-1抑制剂通过阻断肿瘤细胞的PD-L1与T细胞PD-1结合,恢复了T细胞进攻肿瘤的功能,促进肿瘤细胞的凋亡。
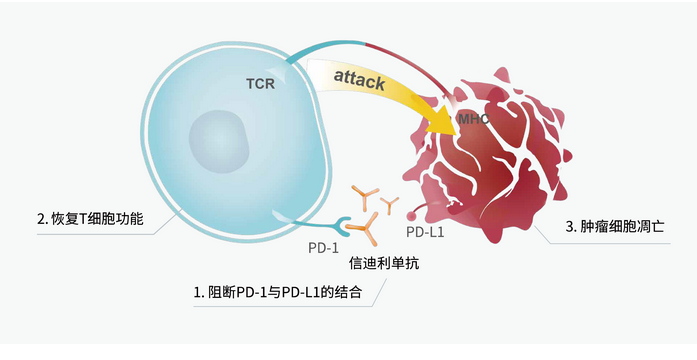
资料来源:信达生物官网
图表3:PD-1抑制剂恢复T细胞抗肿活性 由于PD-L1在多种肿瘤细胞中均有上调表达,所以,PD-1抑制剂是广谱的抗癌药物。2024年,PD-1抑制剂领域中,默沙东的Keytruda和百事美施贵宝的Opdivo的销售额分别为294.82亿美元和101.29亿美元,处于领先地位,而罗氏的Tecentriq和阿斯利康的Imfinzi的销售大约在40-50亿美元左右。 国内PD-1抑制剂领域竞争激烈,市场竞争结构分散。2024年,百济神州的替雷丽珠单抗以44.67亿元销售额稳居第一;信达生物的信迪利单抗的销售额为38.22亿元位居第二;恒瑞医药的卡瑞利单抗的具体销售额未披露,估计在30亿元左右;君实生物的特瑞普利单抗和复宏汉霖的斯鲁利单抗销售收入分别为15.01亿和13.09亿。值得注意的是,康方生物的另外一款双抗卡度尼利单抗(全球首款PD-1/CTLA-4双抗)在2023年的销售额 为13.58亿元,2024年公司并未披露卡度尼利和依沃西单抗的具体销售数据,但公司整体产品销售额为20.02,同比增长24.88%。 康方生物之所以能够出圈,源于其在2024年5月31日披露依沃西单药对比帕博利珠单抗一线治疗PD-L1阳性NSCLC的三期临床取得无进展生存期PFS决定性阳性结果。当天康方生物上涨37.5%。

资料来源:康方生物官网
图表4:AK112头对的对PFS战胜K药 从理论上讲,PD-1/VEGF双靶点药物通过协同作用机制确实展现出超越PD-1单抗的潜力。 不过,目前主要体现在无进展生存期(PFS)的显著改善,但衡量抗癌药物的“金标准”是能否延长患者的总生存期。

HARMONi-2试验OS中期分析在2025年4月26日作出,在ITT人群中,39%的成熟度时,进行总生存期(OS)的期中分析,依沃西单抗对比帕博利珠单抗具有显著的临床生存获益,HR=0.777,降低死亡风险22.3%。受此信息影响,当日SMMT下跌-36.06%。市值从284.58亿美元,跌至181.96亿美元,之后一路震荡下跌,目前SMMT总市值为130亿美元左右。 显然,美股市场并不认可依沃西单抗是对帕博利珠单抗革命性的替代。K药当初之所以能迅速改变治疗格局成为明星药物,是因为其在主要关键临床实验中,展现出总生存期OS获益大幅增长和较低的风险比HR值。
在优势人群(TPS≥50%)阳性患者中,K药让患者总生存期OS大幅延长,OS的风险比HR值能达到0.65的水平。可以这么说,相比原有治疗方案,K药及相关疗法,是革命性的替代。
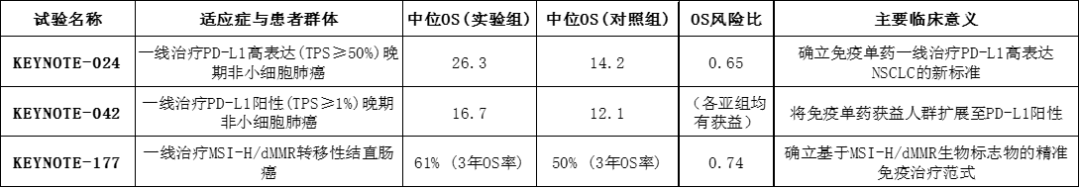
资料整理:deepseek,理忱视野整理
图表5:K药的主要关键临床OS数据 而依沃西的改进主要体现在PFS上,目前公布了OS获益情况的仅有国内试验HARMONi-A,其HR值为0.74,而成熟度39%的HARMONi-2试验,其OS的HR值仅为0.777。
因此,考虑到依沃西OS的获益情况,及其HR值在0.75-0.8之间,所以,初步认定AK112是一个具备VEGF靶点的差异性PD-1单抗。
02 AK112海外市场规模测算对于依沃西单抗(AK112)而言,真正的考验是HARMONi-3研究能否取得PFS与OS双终点的阳性结果。
这是SMMT组织的,和K药头对头的临床试验。该实验主要是AK112联合化疗,对照组为K药联合化疗,一线治疗转移性非小细胞肺癌。HARMONi-3研究研究包括两个不同的NSCLC组织学队列:鳞状(N=600)和非鳞状(N=1000),共约1600例患者。在每个队列中,受试者以1:1的比例随机分配到两个治疗组之一,接受ivonescimab或pembrolizumab联合铂双联化疗。
2026年上半年,预计SMMT完成 HARMONi-3 鳞状非小细胞肺癌患者入组;下半年,预计读出鳞状组的无进展生存期PFS和中期总生存期OS数据。同时,基于HARMONi试验结果,是否获得针对EGFR突变非小细胞肺癌二线及以上治疗的生物制品许可申请结果也会出来。
如果一切进展顺利,预计2027年下半年,依沃西在美国获批非小细胞肺鳞癌治疗。
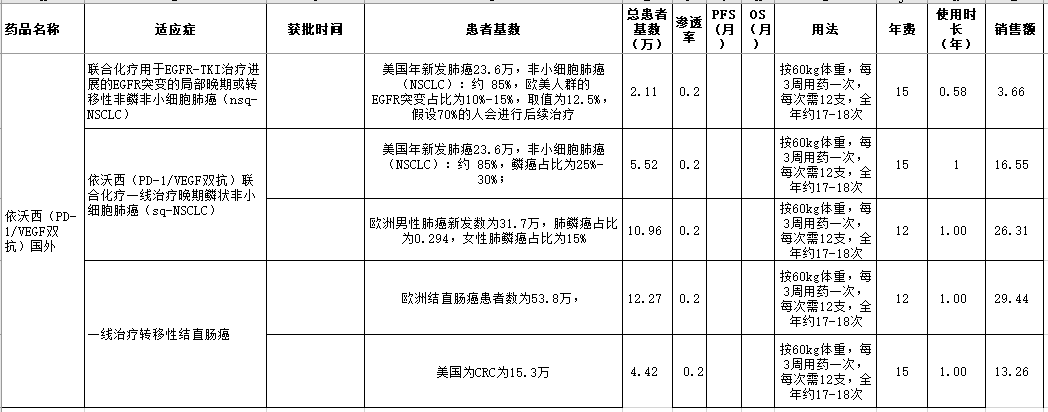
资料整理:理忱视野整理
图表6:依沃西单抗海外市场规模预测 对于EGFR-TKI治疗进展的局部晚期或转移性非鳞非小细胞肺癌患者的市场规模预测,首先,美国的新发肺癌患者人数为23.6万,非小细胞肺癌占比为85%,欧美人群的EGFR突变占比为10%-15%,取值为12.5%,这些患者终究会耐药,假设70%的患者会进行后续治疗,渗透率为20%,则目标人群数量为23.6*0.85*0.125*0.7*0.2=0.421万人,假设美国年费为15万/年,PFS=7个月,使用约等于0.58年,则在该适应症的销售峰值为3.66亿美元。同理可算出欧美肺鳞癌的峰值销售收入为16.55亿元美元和26.31亿美元。所以,如果依沃西的前两个肺癌适应症获批,预计会带来45-50亿美元的峰值销售。
至于主要结束时间在2028年5月31日的一线转移性结直肠癌治疗领域,其对照组为贝伐珠单抗+化疗。如果获批,依沃西将取代贝伐珠单抗在结肠癌治疗的领军地位,这也是贝伐珠单抗使用最高的适应症。 欧洲和美国结肠癌患者分别为53.8万和15.3万,20%的患者在初诊时表现为转移性结直肠癌,另外50%的局部癌也会在病程中发生转移。而RAS突变型占45-50%左右,因此,适合抗血管治疗患者转移性结肠癌患者分别为53.8*(0.2+0.8*0.5)*0.475*0.8=12.27万、15.3*(0.2+0.8*0.5)*0.475*0.8=4.42万,假设依沃西+化疗治疗方案的渗透率为20%,欧洲和美国使用依沃西的年费是12万美元和15万美元,则在一线转移性结直肠癌市场,依沃西单抗所能获得的峰值市场份额为29.44和13.26亿美元,合计为42.7亿美元。 当然愿景是美好的,结果却是不可预测的。考虑到依沃西的OS值的HR只在0.8附近波动,个人觉得以上临床试验成功且药物获批的概率为60%。
03 AK112国内市场估算?当下康方生物已在国内获批两个适应症,分别为EGFR-TKI治疗进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌和单药一线治疗PD-L1表达阳性的晚期NSCLC适应症。 在非肺癌领域,依沃西一线适应症迅速布局:包括一线胆道癌(vs度伐利尤单抗+化疗),联合莱法利单抗(CD47)一线PD-L1阳性头颈鳞癌(vs 帕博利珠单抗)的III期临床正在开展。针对冷肿瘤等领域,依沃西一线三阴性乳腺癌获得第四个突破性疗法认定,依沃西一线MSS/pMMR 型结直肠癌(占CRC 发病的95%)以及一线胰腺癌的III期临床研究正在开展。
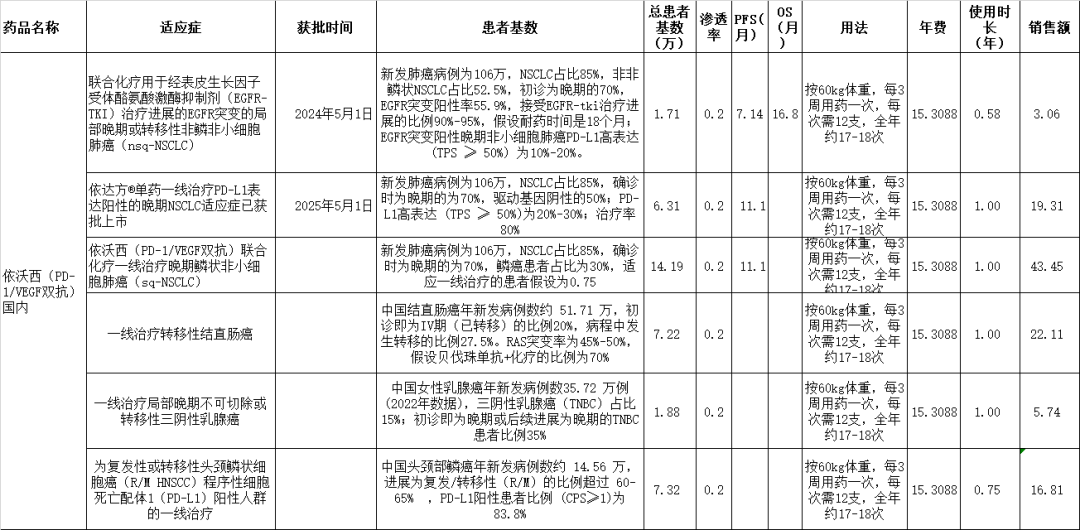
资料整理:理忱视野整理
图表7:依沃西单抗国内市场规模预测 在这些适应症领域,目标患者总数为38.63万,假设是渗透率为20%,则峰值使用人数实际为7.726万人,峰值销售额为110.48亿元。 不过,以上基本假设是依沃西保持15万/年的使用年费,且渗透率能达到20%。但当下国内PD-1单抗普通在4-5万年,加上贝伐珠单抗4万/年的费用,年费总计为8-9万左右,因此,从长期来看依沃西存在进一步降价的可能。 以信达生物的信迪利单抗为例,2024年的销售额为38.22亿元,年使用费用为3.89万元,则当年使用信迪利单抗的患者人数为9.83万人。如果依沃西单抗相比现有疗法,确实能做出OS的优效,相信其使用人数峰值达到7.73万人肯定不存问题,预计到时的价格可能降至8万/年,这样对应的销售额峰值约为61.84亿元。
04 总结依沃西是全球首创的球首创的PD-1/VEGF双抗新药,其屡次在无进展生存期PFS上取得突破,安全性能也是优于传统的抗血管药物。理论上说,抗血管治疗可以改善肿瘤微环境,促进免疫细胞浸润,从而与免疫治疗产生“1+1>2”的协同效应。
不过,大多数抗VEGF药物,经常出现改善了PFS,却无法显著延长总生存期。鉴于此,康方生物的HARMONi-6试验和Summit的HARMONi-3试验将回应这个问题。不管结局怎样,这都是一次突破现有免疫1.0疗法的全新尝试,值得鼓励。

测算20%渗透率是比较笼统的,上面提到的药都是国内医保覆盖的药,那这部分是应该对应医保人群的测算,同时癌症的救命药是要考虑很多为了生命不考虑医保的药,例如k药每年在国内几十亿的销量,如果112做出对比k药的显著差异,这部分人群大部分会被112拿到的。其他那些国产pd-1现在没有pk掉k药的数据,所以基本都是在医保病人的池子内抢份额
|