JCO的肿瘤科查房系列(The Oncology Grand Rounds series)是将临床病例与肿瘤学前沿的关键性研究相结合,帮助读者将相关研究应用于临床实践的专栏。
病例介绍
患者,男性,62岁。主因“咳嗽、呼吸困难1月”就诊,予抗感染、皮质激素治疗,症状无缓解;吸烟史20年,ECOG评分1分。CT提示右肺上叶结节(22mm),同侧气管旁淋巴结肿大(23mm)。PET/CT提示右肺上叶结节、同侧气管旁淋巴结高摄取,临床分期T1c N2 M0(stage ⅢA,eighth AJCC)。
患者的PET/CT影像
临床所存在的挑战
围术期免疫治疗问世之前,围术期的(新)辅助化疗仅提高了5%的5年总生存(OS)率,仍有超过一半的患者在5年内复发。分期的5年OS率:ⅠB为为68%,Ⅱ期的53%-60%,ⅢA期为36%,对我们而言这一结果难以接受。
随后面世于Lancet的IMpower010研究是全球首个公布的术后辅助免疫治疗Ⅲ期随机对照研究。患者在接受辅助化疗之后,1:1随机接受阿替利珠单抗或最佳支持治疗(BSC)。在PD-L1阳性(≥1%)的患者中结果提示辅助阿替利珠单抗可降低34%疾病进展风险,HR(0.66; 95% CI, 0.50 to 0.88; P=0.004);对于PD-L1≥50%的患者则降低57%复发风险,其DFS HR为0.43(95%CI:0.27-0.68)。但该研究目前仍具有如OS数据不成熟;未排除EGFR、ALK突变患者,选择靶向/免疫仍具争议;局部复发/中枢系统转移与对照组差异不明显等局限性。此外,辅助化疗对免疫治疗的预测、评估、结果影响如何,仍需进一步解决。
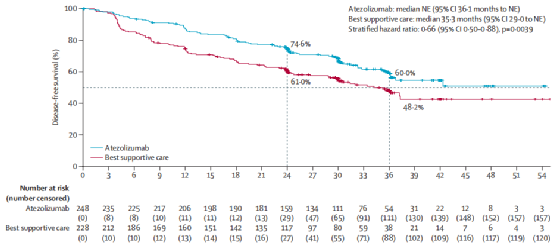
IMpower010 PD-L1阳性患者DFS

IMpower010入组患者EGFR/ALK突变状态
而研究表明,新辅助免疫治疗相比于辅助治疗可能更有效。在动物实验中,与辅助免疫治疗相比,新辅助治疗具有更强的T细胞激活能力及更高的抗肿瘤活性。N Engl J Med.中的一项研究指出,新辅助免疫治疗后在9 / 20(45%)例和2/20(10%)例患者中达到MPR和pCR,MPR组患者的肿瘤和外周血的T细胞克隆数都增加了,在pCR患者中特异性T细胞在外周血扩增,一定程度上验证了动物实验的结果。
随后出现的像“双免疗法”,PD-1单抗联合CTLA-4单抗的NEOSTAR研究,与单独nivolumab(PD-1单抗)相比,“双免疗法”在MPR和pCR方面显示出优越性,MPR和cPR分别为38% v 24%和29% v 9%,同时效应细胞和组织驻留记忆T细胞的分布更为密集。
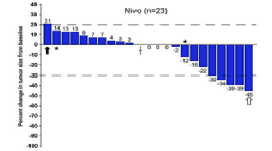
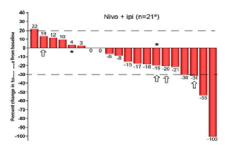
最后一次新辅助治疗至少14d后,从基线评估肿瘤大小变化
g.h分别为效应细胞和记忆细胞定量
然而,联合用药则必然要考虑到其安全性及不良反应,另一项试验则因出现33%(3/9)的≥3级的不良反应而提前终止。
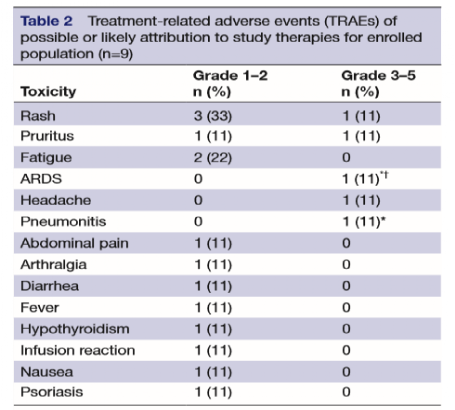
相关不良事件(n=9)
而NEOSTAR中,≥3级治疗相关不良事件在“双免疗法”组【10%(2/21)】却略低于免疫单药【13%(3/23)】,由此可见,“双免疗法”前景仍广阔,需要去进一步筛选获益人群。
目前发现,可能由于化疗可诱导肿瘤溶解、使肿瘤抗原释放增强免疫反应等生物学原因,新辅助化疗联合免疫治疗在无论PD-L1表达高低的人群中皆展现出独特优势。
在另一综述(Cancer Discov. 2021 Jun;11(6):1353-1367.)描述了免疫联合化疗相关的可能机制和化疗药物的选择上的策略。
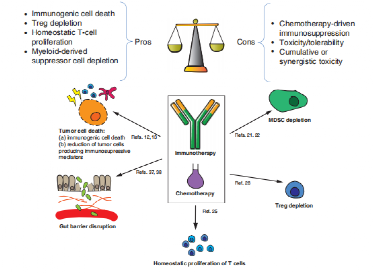
化疗联合免疫治疗机制上的优劣
联合免疫治疗,化疗药的选择策略
新辅助免疫联合化疗相关研究
一、LANCET ONCOLOGY发表的一项单组II期临床研究评估了30例IB-IIIA期NSCLC(77%为IIIA期)患者使用白蛋白结合型紫杉醇联合阿替利珠单抗4个周期后的疗效。87%的患者可以达到R0切除(与单纯新辅助化疗的历史基准相似),14例患者的pCR和MPR分别为33%和57%。
二、LANCET ONCOLOGY--NADIM 新辅助免疫联合化疗(3个周期)→手术→辅助免疫治疗(1年),为IIIA期NSCLC患者,排除了EGFR/ALK突变。多站N2患者占54%,但经历了手术的患者都获得了R0切除。83%的接受手术的患者实现了MPR, 63%的患者实现了pCR。主要研究终点24个月无进展生存期(PFS)在总体人群中为77.1% (95% CI, 59.9 - 87.7)。
ITT人群(n=46)的DFS
三、CheckMate 816-NEJM:首个公布关于肺癌新辅助免疫治疗的全球多中心III期临床研究,试图去确定新辅助免疫联合化疗的地位,主要终点为pCR和无事件生存期(EFS)。在该研究中,358例手术可切除的Ib期-IIIA 患者,无EGFR或ALK突变,1:1随机分配至新辅助免疫联合化疗和新辅助化疗组(3个周期),联合疗法使接受手术的患者比例从75%提高到83%,且无论分期、PD-L1水平、TMB如何,联合疗法将pCR率从2%提高到24% (P=.0001);MPR也得到了改善(37% vs 9%)。中位EFS从20.8个月延长至31.6个月,HR为0.63 (95% CI, 0.43 - 0.91;P=.005)。
在可切除NSCLC的新辅助免疫联合化疗的几项试验中,pCR率从9%到63%不等,≥3级的毒性反应主要与化疗有关。
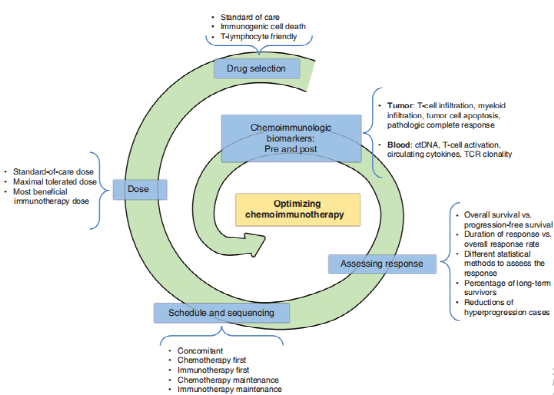
这些试验建立了一个关键的治疗转变,研究人员已经开始关注如何在临床特征和肿瘤生物标志物的基础上优化这些治疗。关键问题包括以下几个方面:
·使用替代临床终点
相较于辅助治疗常选用DFS,新辅助治疗多选用EFS,主要是新辅助治疗时需要明确治疗期间发生肿瘤进展或因为其他原因而无法手术的患者,对这类患者进行划分有利于进一步精准治疗。无疾病生存(Disease Free Survival, DFS):是指从随机化开始(或单臂试验中治疗开始)至疾病复发或任何原因导致死亡的时间(以先发生者为准),多用于评价手术治疗或放疗后的辅助治疗。
无事件生存(Event Free Survival, EFS):是指从随机化开始(或单臂试验中治疗开始)到首次发生以下任何事件的时间: 疾病进展而无法进行手术治疗、局部或远处复发、任何原因导致的死亡等,多用于评价手术治疗或放疗前的新辅助治疗。
·研究终点的选择
替代病理学终点,尤其是pCR和MPR的作用目前尚无定论。新辅助化疗的历史数据仅显示这些终点与生存期之间存在正相关。新辅助免疫的MPR率总体上高于新辅助化疗(历史数据范围为15%-20%),在CheckMate 816试验的探索性分析中,有pCR的患者的EFS长于没有pCR的患者。而历史评价的金标准一直是OS(尽管OS的地位也一直伴随着不少质疑)。ESMO2020汇报的CA209-8Y9系统评价和meta分析结果提示NSCLC新辅助化疗若达到pCR或MPR,与患者更好的OS、EFS结果有关。
而在BMJ发表的系统评价和meta分析了乳腺癌的多种新辅助治疗方法,结果提示pCR无法作为无病生存期(DFS)和总生存期(OS)的替代终点。
·按分期和缓解效果来设计研究
正在进行的Ⅲ期临床试验着重于研究围手术期的免疫治疗的作用,以免疫治疗为基础联合用药,贯穿新辅助、辅助治疗。而对于已获得pCR以及相对早期的患者来说,辅助治疗的价值仍未确定。在CheckMate816研究中,Ib期-IIIA期患者从pCR来看,都是获益的,但Ib-Ⅱ期在EFS的获益却不明显,对于这一部分患者,还需要进一步的研究来指导临床决策。
正在进行的Ⅲ期临床试验
·评估PD-L1及TMB
在辅助免疫治疗中的获益似乎是受了PD-L1高表达队列患者(DFS HR, 0.43;95% CI, 0.27 - 0.68)的影响,辅助治疗整体而言存在争议。尽管PD-L1水平可以预测放射学或病理学的疗效评价,但在NADIM研究中并未观察到PD-L1/TMB跟最终获益的联系。在CheckMate 816试验中则观察到PD-L1/TMB表达水平跟疗效相关。
·液体活检:ctDNA
研究前景广阔,有研究指出ctDNA的清除与病理缓解,更好的PFS、OS相关,有望用作疗效评估,CheckMate816研究也印证了这一点,且在新辅助免疫组ctDNA清除率更高。术后ctDNA评估可能有助于识别复发,避免昂贵和潜在毒性的辅助治疗。
CheckMate816研究ctDNA清除与EFS关系
·基因组分子图谱的作用
在新辅助治疗的研究里面常将EGFR/ALK突变患者排除在外,而辅助治疗中却没有排除,对于这些患者可能更优选的是靶向治疗。
·外科手术--肿瘤学视角
涉及到外科手术则必然要考虑到新辅助治疗有无因TRAEs而延误手术的风险?有无增加手术难度、被迫中转开胸、术后并发症的风险?在CheckMate 816研究中,新辅助免疫联合化疗组的微创手术率更高,肺叶切除术率更高(77% vs 61%),全肺切除术率更低(17% vs 25%),这一结果有望打消这方面的顾虑。
回顾开头病例:我们的治疗决策
患者临床分期T1c N2 M0(stage ⅢA,eighth AJCC),考虑为N2潜在可切除,根据指南,应考虑新辅助治疗,所以该患者目前正在接受新辅助化疗(新辅助免疫治疗并未在欧洲获批)。但我们认为,患者更适合接受新辅助免疫联合化疗方案。此外,考虑到辅助治疗在CheckMate 816研究中没有得到评估,我们不会考虑新辅助免疫治疗后提供额外的辅助治疗。同时我们认为,所有早期非鳞状NSCLC患者都应该接受二代测序,以识别潜在突变,同时分子谱应与吸烟状况联系起来,以便更好地指导临床决策。由于异质性的原因,我们认为早期NSCLC治疗模式必须由多学科综合决策,包括临床评估、胸部影像学(包括PET/CT)、脑评估(首选MRI)、纵隔分期(通过支气管超声或纵隔镜)、早期广泛的基因组检测和PD-L1评估,以及ctDNA,为正确决策提供有力依据。
思考:
1.关于病理学替代终点能否替代OS等的相关研究,主要集中在新辅助化疗等方面,鲜有涉及到免疫治疗,这些研究对新辅助免疫来说指导意义如何?
2.围术期临床研究辅助治疗方案不尽相同,新辅助治疗/手术后如何选择方案,随访(ctDNA-MRD评估)?先化疗后免疫?先免疫后化疗?免疫联合免疫/化疗/抗血管?免疫单药?
3.新辅助免疫治疗关口前移的必要性?根据手术难度制定新辅助治疗决策的合理性和规范性?
4.在PD-L1、TMB阴性患者新辅助免疫获益的前提下,探索新辅助标志物的必要性?能否进一步精准筛选PD-L1、TMB阴性患者获益人群?
5.正如在The ADJUVANT Study中,EGFR突变的患者并不一定适用于靶向治疗(RB1阳性),这部分人群是否有望首选应用免疫治疗?EGFR亚分类人群是否需要重新考虑治疗决策?有研究提出ALK会诱导PD-L1表达,该部分群体围手术期治疗决策?罕见突变患者群体围术期治疗决策? |