前言
NSCLC新辅助化疗已应用多年,总生存5%的获益已达到瓶颈。免疫治疗的出现为传统新辅助治疗方案拓展了新思路,提供了新手段和新希望,但目前已批准的适应症和多项研究仍在无驱动基因突变的人群中进行。免疫联合化疗模式用于表皮生长因子受体(EGFR)突变阳性非小细胞肺癌(NSCLC)新辅助治疗是一次大胆尝试与全新的突破。
EGFR(+)新辅助困境
术前新辅助治疗可以提高可手术性并改善患者预后,给患者带来生存获益。既往研究发现,传统的新辅助化疗给患者带来的获益有限。
EGFR突变是NSCLC发生率最高的驱动基因突变类型,其在亚裔人群中的发生率高达40%~60%,EGFR-TKI的出现开启了肺癌靶向治疗时代[1]。首个探索III期肺癌患者新辅助靶向治疗的EMERGING-CTONG1103研究,结果显示一代EGFR TKI厄洛替尼联合化疗与化疗相比,无进展生存期(PFS)显著延长,但总生存期(OS)数据无显著差异。而2023年 ASCO年会公布了一项奥希替尼新辅助治疗可手术EGFR突变NSCLC患者的II期临床研究,结果显示纳入EGFR突变NSCLC患者共27名,中位接受奥希替尼新辅助治疗的时间为56天,主要病理缓解(MPR)为15%,没有达到主要终点,病理完全缓解(pCR)为0%(0/27)。
值得注意的是,尽管靶向新辅助治疗表现出了较好的肿瘤控制效果,但在病理学缓解方面表现差强人意,且靶向新辅助治疗尚缺乏III期随机对照临床研究。相比之下,近年兴起的免疫治疗新辅助不仅能使患者瘤体出现明显退缩,病理学缓解更深,能够为患者带来更长生存获益。因此免疫新辅助治疗是否能应用于EGFR及其它驱动突变的肺癌患者也成为了临床研究尝试和关注的领域方向。
新辅助化免与驱动基因阳性肺癌的碰撞
以EGFR基因突变为代表的驱动基因阳性NSCLC既往一直被认为是免疫治疗的“禁区”,但随着对免疫调节作用的深入认识及临床证据的不断生成,免疫治疗有望为驱动基因阳性NSCLC患者带来新希望。2022年由广东省肺癌研究所钟文昭教授团队联合浙江荣军医院,北京肿瘤医院,湖南省肿瘤医院,唐都医院,天津医科大学肿瘤医、山东齐鲁医院等国内中心在Nature旗下子刊NPJ Precision Oncology发表的成果显示,纳入的40例患者(包括19例EGFR突变,其他如KARS,HER20插入,RET,BRAF, ALK和ROS1)大部分均接受新辅助免疫联合化疗,新辅助治疗后影像学/病理学确认N2的降期率为60%,接受手术治疗患者中仅一例为R2切除,其余均达到R0切除。整体病理缓解率MPR(原发灶残留肿瘤细胞不超过10%)为37.5%,pCR(无肿瘤细胞残留)为12.5%。回顾性数据证实新辅助免疫联合化疗对EGFR突变患者具有一定临床应用前景,因此CTONG2104研究应运而生。近期,此项两阶段设计、开放标签、单中心Ⅱ期临床研究NEOTIDE(CTONG2104)公布了其试验中期结果,研究探索了免疫联合化疗新辅助治疗早期EGFR突变阳性NSCLC的治疗效果,值得注意的是该研究不仅入组常见敏感EGFR,同时允许少见EGFR突变包括EGFR20插入患者,其中第一阶患者中有将近一半患者均为EGFR少见突变。
研究结果
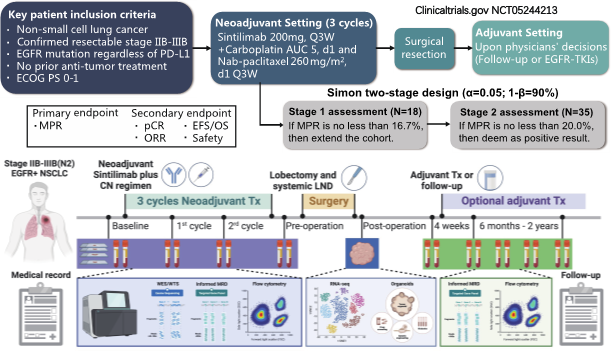
研究结果显示在18例完成新辅助治疗并接受手术治疗的患者中,14例( 78 % )患者达到部分缓解( PR ),4例( 22 % )患者疾病稳定( SD ),治疗前后PET / CT未见影像学进展( PD )。
在接受手术治疗的患者中,8例( 44 % )患者达到MPR ,其中4例患者接近pCR ,残留1 %存活肿瘤( RVT )。1期队列未观察到pCR。
安全性方面,接受新辅助治疗的18例患者均出现了治疗相关不良事件( TRAEs ),7例( 39 % )患者出现了3 / 4级TRAE,其中1例患者在经皮肺穿刺活检过程中因咯血而出现严重不良事件( SAE )。最常见的不良反应为脱发( 83 % ),其次为恶心( 78 % )、感觉异常( 61 % )和粒细胞减少( 39 % )。仅1例患者确诊为甲亢免疫相关AE ( ir AE )。
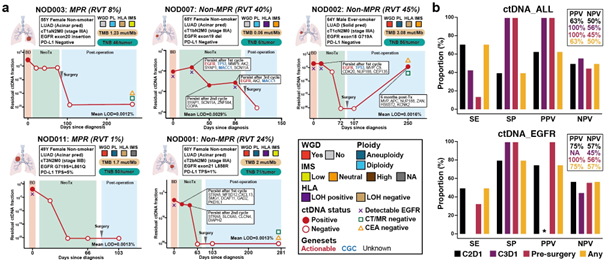
本研究前瞻性地收集了12名患者的77份血液和组织样本,并使用基于全外显子组测序的肿瘤信息个性化ctDNA面板进行了分析。12名患者均检测到了ctDNA,81%(9/11)的患者在基线时检测到了相应的表皮生长因子受体(EGFR)突变。在不同的治疗周期中,PPV 都比 NPV 高,其中手术前的 ctDNA 检测可产生相对较高的 PPV 和 NPV,而与总体 ctDNA 水平或 EGFR 突变无关。
研究小结
EGFR突变作为非小细胞肺癌发生率最高的驱动基因突变类型,尽管在早期辅助治疗取得重大进展,但在新辅助领域仍举步维艰,近年多项研究如NEOS研究,均未显示出新辅助靶向治疗在EGFR突变患者具有较好病理缓解疗效。虽然晚期肺癌研究显示免疫治疗在EGFR突变患者中疗效欠佳,但在新辅助免疫治疗模式下仍缺少相关数据,NEOTIDE(CTONG2104)研究成果的发布可谓为免疫新辅助治疗EGFR突变阳性NSCLC提供了一定数据支持,根据本研究结果提示,新辅助免疫联合化疗方案在早期EGFR突变阳性NSCLC (包括EGFR插入型和其他少见亚型)中具有一定的临床可行性和良好的安全性,后续仍需要进一步随访数据明确新辅助免疫联合化疗模式在早期/局部晚期EGFR突变肺癌应用前景。
参考文献
参考文献:
[1] 张雨珊,韩毅,车南颖等.新辅助免疫治疗联合化疗对局部晚期非小细胞肺癌疗效的初步研究[J].中国医刊,2022,57(09):1016-1020.
[2] 赵阳,杨丽涛,苑广奎等.新辅助化疗应用于Ⅲa期非小细胞肺癌的效果评价[J].潍坊医学院学报,2021,43(06):414-417+481-482.DOI:10.16846/j.issn.1004-3101.2021.06.005.
[3] 李大伟,夏世辉.Ⅲ期非小细胞肺癌病人新辅助化疗联合免疫治疗后无病生存的影响因素分析[J].临床外科杂志,2023,31(07):626-629.
[4] 郭超,张家齐,李单青.非小细胞肺癌新辅助免疫治疗进展[J].中国肺癌杂志,2022,25(07):524-533.
[5] 晚期驱动基因阳性非小细胞肺癌免疫治疗专家共识(2022 版)
[6] Chao Z,Fei H C,Shi Y, et al. Induction immune-checkpoint inhibitors for resectable oncogene-mutant NSCLC: A multicenter pooled analysis[J]. npj Precision Oncology,2022,6(1).
|
